AGUA
El
agua es el medio biológico de la Tierra.
¿Qué
quiere decir esto?
Es
la biomolécula más abundante y también más importante. La vida como se conoce en
la Tierra, se desarrolla SIEMPRE en medio acuoso. Incluso en los seres no
acuáticos, el medio interno es esencialmente hídrico. De hecho, la búsqueda de vida en otros planetas está supeditada a la presencia de agua.
Y
esto es debido a que la vida comenzó en el agua y evolucionó allí por 3 mil
millones de años antes de extenderse a la tierra. Y una vez que se “independizó”
de la misma, es decir, conquistó el medio terrestre,
igual se mantuvo ligada a esta biomolécula para gran cantidad de reacciones
metabólicas.
Nosotros
mismos, sin incorporar agua solo sobreviviríamos entre 3 a 5 días, mientras que
si no nos alimentamos, pero mantenemos una ingesta mínima de agua, podríamos llegar
a soportar entre 28 a 42 días.

El agua cubre el 71% de la superficie terrestre. Se localiza principalmente en los océanos, donde se concentra el 96,5% del agua total, los glaciares y casquetes polares con el 1,74%, los acuíferos suponen un 1,72% y el 0,4% restante se reparten entre lagos, humedad del suelo, atmósfera, embalses y ríos.
En
la naturaleza se encuentra en los tres estados: sólido (hielo o nieve), líquido
y gaseoso (vapor de agua). En océanos, ríos, nubes y lluvia están en constante
cambio, el agua de la superficie se evapora, el agua de las nubes precipita, la
lluvia se filtra por la tierra. Sin embargo, la cantidad total de agua en el
planeta no cambia. La circulación y conservación de agua en la Tierra se llama “ciclo hidrológico”.
Dentro
de los seres vivos, el agua también es la molécula más abundante, y representa
entre un 70 a 90% del peso de la mayoría de los organismos. Su papel primordial
es en el metabolismo, y se debe a sus propiedades físico-químicas, derivadas de
la estructura molecular que posee.
http://www.anda.gob.sv/calidad-del-agua/fuentes-de-agua/
Pero, ¿qué es el agua?
Es
una pequeña biomolécula inorgánica formada por 3 átomos: 2 Hidrógenos unidos
a 1 Oxígeno mediante enlaces covalentes. Si se la analiza aislada, es una molécula falsamente simple.
El
oxígeno al ser más electronegativo que el hidrógeno hace que los electrones de
los enlaces polares pasen más tiempo cerca de él. Por lo tanto, los enlaces que
mantiene unida a la molécula de agua son enlaces covalentes polares.
Esta
atracción desigual hace que la molécula sea un dipolo, es decir, presenta un
polo positivo (lado de los hidrógenos) y un polo negativo (lado del oxígeno).
Entre
los dipolos del agua de establecen fuerzas de atracción llamadas “puentes de hidrógeno”. Debido a que el oxígeno de una molécula tiene dos pares libres de
electrones, cada uno de ellos puede formar enlace por puente de hidrógeno con
otras dos moléculas y los dos hidrógenos con otras dos moléculas más. Por lo
tanto, una molécula puede unirse a cuatro moléculas más.
http://www.bionova.org.es/biocast/tema04.htm
Debido a estos enlaces, y la posición de sus átomos en la molécula, el agua es un líquido fundamental y contiene grandes anomalías en sus propiedades.
Punto de fusión→ 0°C
Punto de ebullición→ 100°C
Es líquida a temperatura ambiente, debido a que los puentes de hidrógeno mantienen a las moléculas unidas. Por eso, aunque por su peso debería ser un gas, es un líquido.
Densidad máxima→ 4°C
tiene mayor densidad en estado liquido que en estado solido. Los puentes e hidrógeno "congelados" mantienen las moléculas más separadas que en estado liquido. Por ello, el hielo flota sobre el agua y en climas fríos los lagos y mares se congelan solo en la superficie y el hielo actúa como aislante para que en las capas inferiores el agua permanezca líquida y sea posible la vida acuática.
http://ve.tiching.com/dilatacion-anomala-del-agua/recurso-educativo/748803
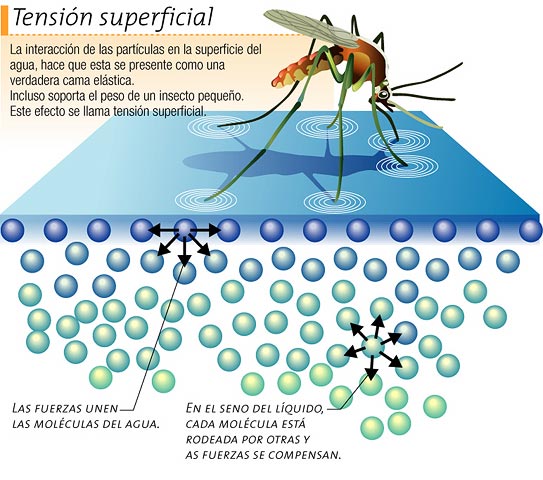
Tensión superficial
Las moléculas de la superficie están fuertemente unidas entre sí y a otras del interior - la superficie es como una piel tensa pero elástica, de la que cuesta separar moléculas. Algunos organismos pequeños y livianos se desplazan por la película superficial del agua.
https://www.unav.edu/documents/11140003/25850494/tensio%CC%81n+superficial.pdf

http://japac.gob.mx/2016/04/02/caminar-sobre-el-agua-es-posible-la-tension-superficial/
Alto calor de Vaporización
Para que el agua comience a evaporarse hay que suministrar energía calorífica suficiente para que las moléculas rompan sus puentes de hidrógeno y salgan del liquido. Los seres vivos utilizan esta propiedad para refrescarse al evaporarse el sudor.

http://bioquimicaqfbpepe.blogspot.com/2018/
Solvente Universal
El agua es considerada el disolvente universal por ser el líquido que más sustancias disuelve. Esta propiedad es debido a su capacidad para formar puentes de hidrógeno con otras sustancias como hemos mencionado previamente.
Esta capacidad de disolvente es la responsable de dos funciones importantísimas para los seres vivos:
- Actúa como medio para que se produzcan la mayoría de las reacciones metabólicas.
- Aporta nutrientes y contribuye a la eliminación de desechos a través de sistemas de transporte acuosos.

Cohesión y Adhesión
La cohesión se define como la unión entre las moléculas de agua y la adhesión es la unión a otras moléculas con cargas eléctricas netas o débiles.
Otras fuentes bibliográficas: https://agua.org.mx/propiedades-derl-agua/
Campbell, Reece "Biología" (2007).Madrid, España. Pg 47.


Comentarios
Publicar un comentario